|
Entropía y Segundo Principio de la Termodinámica.
Máquina de Carnot Carnot diseñó una máquina que trabajaba con dos focos a distinta temperatura. Del foco a mayor temperatura extraía calor y cedía calor al foco de menor temperatura. No es nada raro, el motor de un coche funcione de esta manera. Extrae el calor de la combustión de la gasolina y cede parte de este calor al circuito de refrigeración y a las piezas que forman el motor. La diferencia entre el calor que captaba del foco caliente y el que se cedía al foco frío se transformaba íntegramente en trabajo.
Imaginemos que la máquina de Carnot es un pistón (émbolo) que se desliza por una camisa o cilindro. Carnot diseñó su máquina para que trabajase en cuatro etapas formando un ciclo:
1º Por efecto del foco caliente, el gas interior se expande. Esta expansión se produce a temperatura constante (expansión isoterma). 2º Una vez retirado el foco caliente el gas sigue expandiéndose por sí mismo sin intercambio de calor (expansión adiabática). 3º El foco frío capta calor del gas y se produce una disminución de su volumen. Esa compresión se produce a temperatura constante (compresión isoterma). 4º Se aparta el foco frío y el volumen sigue disminuyendo. En este proceso no hay intercambio de calor (compresión adiabática), volviendo el pistón a su posición inicial.
Se dice que la máquina de Carnot trabaja entre dos isotermas y dos adiabáticas.
Rendimiento de la máquina de Carnot Un esquema simplificado de la máquina de Carnot es, como ya hemos visto anteriormente, el que aparece más abajo.
El trabajo obtenido por la máquina es:
y, el rendimiento energético vendría dado por la expresión:
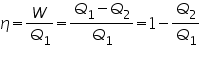
Se puede demostrar que: 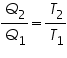
Con lo que:
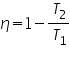
O sea, el rendimiento de la máquina depende de la diferencia de temperaturas entre el foco caliente y el foco frío. Cuanto mayor sea esa diferencia de temperaturas (mayor sea T1 y menor sea T2) mayor será el rendimiento de la máquina.
Entropía
Si reordenamos un poco la expresión anterior:
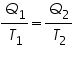
y pasando el primer miembro al segundo:
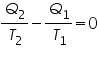
Detengámonos en esta expresión. Hay un término nuevo, Q/T, y, según la expresión anterior, podemos decir que la diferencia entre Q/T que entra y Q/T que sale de la máquina de Carnot es cero.
O, lo que es lo mismo,
Q/T de lo que entra es igual a Q/T de lo que sale (lo que entra sigue siendo lo mismo al salir).
A ese cociente Q/T, Clausius lo denominó ENTROPÍA, S.
Esto es lo que ocurre en una máquina de Carnot que, como hemos dicho, trabaja entre dos isotermas y dos adiabáticas.
Segundo Principio de la Termodinámica. En la vida real, la diferencia Q1-Q2 no se transforma íntegramente en trabajo, W. Y eso sucede porque no hay procesos adiabáticos en la vida real, ni tampoco existen procesos isotermos. Siempre se pierde calor en forma de rozamientos, conducción, etc.
Dicho de otra manera, en una máquina real se produce menos trabajo y se desprende más calor.
La primera consecuencia de esto es que "No hay ninguna máquina que funcione mejor que la de Carnot".
Otra consecuencia es que, si una máquina real realiza menos trabajo, W, y desprende más calor, Q2, que una máquina de Carnot entonces
A la expresión
se la conoce como el SEGUNDO PRINCIPIO DE LA TERMODINÁMICA. En una máquina real: se produce entropía se crea entropía
la entropía aumenta
La entropía que sale de una máquina real es siempre mayor que la que entra.
Todas las máquinas reales "fabrican" entropía.
Pero, ¿hasta cuándo estará aumentando la entropía?. Respuesta: Hasta que no pueda suceder otra cosa; hasta el estado de equilibrio.
Cuando un cuerpo recibe calor a una temperatura su entropía aumenta hasta el estado de equilibrio.
Entropía y desorden Supongamos un trozo de hielo que lo estamos calentando.
Mientras esté absorbiendo calor a una temperatura, la entropía irá aumentando según la ecuación:
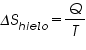
Según lo anterior, parece ser que existe una relación entre aumento de entropía y el aumento del desorden.
En la naturaleza existen muchos procesos que tienden a darse (en adelante espontáneos) donde se aumenta el desorden y, además, es improbable el proceso inverso. Veamos unos ejemplos:
a) Un terrón de azúcar se disuelve de forma espontánea en una taza de café, pero el azúcar disuelto nunca reaparece espontáneamente en su forma original. Inicialmente el azúcar estaba en un estado más ordenado que una vez disuelto. b) Un trozo de sodio metálico reacciona de manera violenta con agua para formar hidróxido de sodio e hidrógeno gaseoso. Sin embargo, el hidrógeno gaseoso no reacciona con el hidróxido de sodio para formar agua y sodio. Aquí, el estado inicial también es más ordenado que el final. c) Cuando perfumo una habitación con un aerosol el gas se esparce por toda ella aumentando el desorden de las partículas.
Vemos, por tanto, que por regla general (aunque no siempre) los procesos espontáneos están asociados a un aumento de entropía y desorden.
Como el segundo Principio de la Termodinámica dice que la entropía aumenta podremos decir que en todos los procesos reales el desorden aumenta.
Y así lo demostró Boltzmann en 1868.

Boltzmann dijo que la entropía, S, de un sistema se relaciona con el logaritmo natural (logaritmo neperiano) del número de microestados (W):
S = k·lnW
donde k se denomina constante de Boltzmann (1,38·10-23J/K). Por lo tanto, cuanto mayor sea W, mayor es la entropía del sistema.
En los casos que nos ocupa, un microestado no es más que una ordenación concreta de un sistema.
Por ejemplo: Supongamos 4 partículas A, B, C y D encerradas en un compartimento de los dos existentes en una caja. Ambos compartimentos se pueden unir mediante la eliminación de un tabique central. ¿Qué creéis que pasará si eliminamos ese tabique?, ¿habrá unas disposiciones preferentes? Las partículas se podrán disponer de varias maneras:
A cada disposición distinta se le denominaría microestado. Podemos observar que existen más microestados, W, en los que hay dos partículas en cada compartimento por lo que cuando se elimina el tabique es más probable que las partículas se repartan por igual en los dos estanques, de hecho, es lo que ocurre. Estudiemos este caso con la fórmula de Boltzmann.
El cambio en la entropía para un determinado proceso, ΔS, es
ΔS = Sf-Si
donde Si y Sf son las entropías del sistema en los estados inicial y final, respectivamente. Se puede escribir
ΔS = k·lnWf-k·lnWi
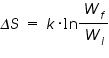
En el ejemplo que nos ocupa, el número de microestados final en los que las 4 partículas están uniformemente distribuidas, es máyor que en el estado inicial, por lo que Wf>Wi y, así, ΔS>0 y la entropía del sistema aumenta, con lo que estaría de acuerdo con el Segundo Principio de la Termodinámica.
En otras palabras, estarán favorecidos los procesos donde el número de microestados aumente y, como hemos visto con el anterior ejemplo, el desorden posee un mayor número de microestados que el orden. Energía libre de Gibbs Imaginemos un trozo de hielo al que le damos calor:
Para el hielo:
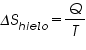
Para el resto del Universo que cede ese calor al hielo:
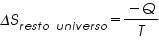
Para un proceso espontáneo, la segunda ley establece que ΔSuniv debe ser mayor que cero, pero no pone restricciones a los valores de ΔSsist o ΔSalrededores. Entonces, es posible que ΔSsist o ΔSalred sean negativos, siempre y cuando ΔSuniv sea mayor que cero.
Si sustituimos:

Para un proceso isóbaro podemos escribir:
Esta ecuación establece que para un proceso que se lleve a cabo a presión constante y temperatura T, si los cambios en la entalpía y en la entropía del sistema son tales que ΔHsist-T·ΔSsist es menor que cero, el proceso debe ser espontáneo. A esa cantidad se le denomina Energía libre de Gibbs y al igual que hemos enunciado el segundo principio podemos decir que:
Todo proceso cuya energía libre de Gibbs sea negativa tenderá a darse o, dicho de otra manera, será un proceso espontáneo.
|